บทที่1 อะตอมและตารางธาตุ
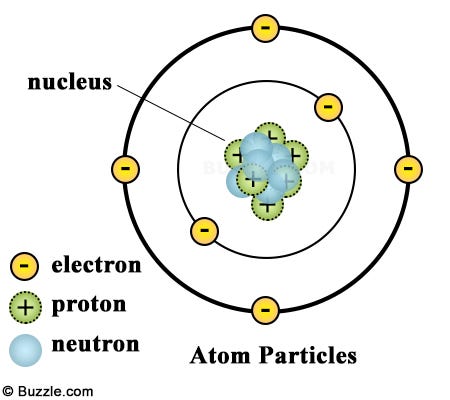
อังกฤษ: Atom) คือหน่วยพื้นฐานของสสาร ประกอบด้วยส่วนของนิวเคลียสที่หนาแน่นมากอยู่ตรงศูนย์กลาง ล้อมรอบด้วยกลุ่มหมอกของอิเล็กตรอนที่มีประจุลบ นิวเคลียสของอะตอมประกอบด้วยโปรตอนที่มีประจุบวกกับนิวตรอนซึ่งเป็นกลางทางไฟฟ้า (ยกเว้นในกรณีของ ไฮโดรเจน-1 ซึ่งเป็นนิวไคลด์ชนิดเดียวที่เสถียรโดยไม่มีนิวตรอนเลย) อิเล็กตรอนของอะตอมถูกดึงดูดอยู่กับนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า ในทำนองเดียวกัน กลุ่มของอะตอมสามารถดึงดูดกันและกันก่อตัวเป็นโมเลกุลได้ อะตอมที่มีจำนวนโปรตอนและอิเล็กตรอนเท่ากันจะมีสภาพเป็นกลางทางไฟฟ้า มิฉะนั้นแล้วมันอาจมีประจุเป็นบวก (เพราะขาดอิเล็กตรอน) หรือลบ (เพราะมีอิเล็กตรอนเกิน) ซึ่งเรียกว่า ไอออน เราจัดประเภทของอะตอมด้วยจำนวนโปรตอนและนิวตรอนที่อยู่ในนิวเคลียส จำนวนโปรตอนเป็นตัวบ่งบอกชนิดของธาตุเคมี และจำนวนนิวตรอนบ่งบอกชนิดไอโซโทปของธาตุนั้น