บทที่3 ธาตุและสารประกอบ
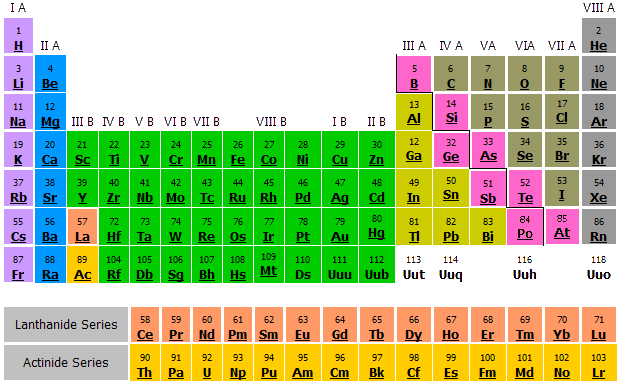
ตารางธาตุ (Periodic table of elements) คือ ตารางที่นักวิทยาศาสตร์ได้รวบรวมธาตุต่างๆ ไว้เป็นหมวดหมู่ตามลักษณะ และคุณสมบัติที่เหมือนกัน เพื่อเป็นประโยชน์ในการศึกษา ในแต่ละส่วนของตารางธาตุ โดยคาบ (Period) เป็นการจัดแถวของธาตุแนวราบ ส่วนหมู่ (Group) เป็นการจัดแถวของธาตุในแนวดิ่ง ซึ่งมีรายละเอียดดังต่อไปนี้
รหัสสีของธาตุกลุ่มต่างๆ
| |||
หมู่โลหะอัลคาไล (Alkali Metal)
|
อโลหะ (Non-Metal)
| ||
หมู่โลหะอัลคาไลเอิร์ธ (Alkali Earth Metal)
|
ก๊าซมีตระกูล (Noble Gas)
| ||
หมู่โลหะแทรนซิชัน (Transition)
|
แลนทาไนด์ (Lanthanide)
| ||
โลหะอ่อน
|
แอกทิไนด์ (Actinide)
| ||
กึ่งโลหะ (Metalloid)
| |||
ภาพที่ 5 ตารางธาตุในปัจจุบัน
การจัดหมวดหมู่ในตารางธาตุ
1. ธาตุหมู่หลัก หรือธาตุหมู่ A มีทั้งหมด 8 หมู่ (ตั้งแต่ I A-VIII A) 7 คาบ โดยธาตุที่อยู่ด้านซ้ายของเส้นขั้นบันได จะเป็นโลหะ (Metal) ส่วนทางด้านขวาเป็นอโลหะ (Non metal) ส่วนธาตุที่อยู่ติดกับเส้นขั้นบันไดนั้น จะเป็นกึ่งโลหะ (Metalloid)
2. ธาตุทรานซิชัน หรือธาตุหมู่ B มีทั้งหมด 8 หมู่ (ตั้งแต่ I B-VIII B) แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ
3. ธาตุอินเนอร์ทรานซิชัน มี 2 คาบโดยมีชื่อเฉพาะเรียกคาบแรกว่า คาบแลนทาไนด์
(Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28 ตัว
(Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28 ตัว
สัญลักษณ์ของธาตุ ใช้เป็นสัญลักษณ์แทนธาตุ 1 อะตอม แต่เนื่องจากธาตุมีอยู่หลายชนิด จอห์น ดอลตัน (John Dallton ค.ศ. 1766-1844) นักวิทยาศาสตร์ชาวอังกฤษ จึงเสนอให้มีการใช้รูปภาพเป็นสัญลักษณ์แทนชื่อธาตุ เช่น
ความหมายของธาตุและสารประกอบ
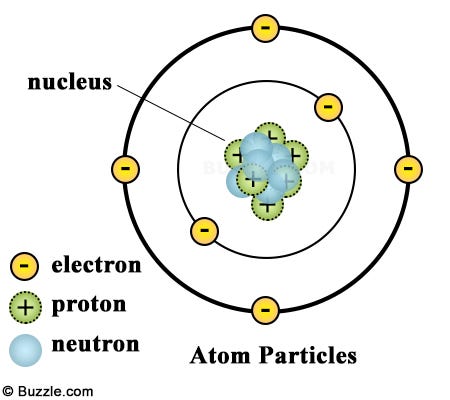
ธาตุ (Element) คือ สารบริสุทธิ์ที่ประกอบด้วยธาตุหรือสารชนิดเดียว ไม่สามารถแยกหรือสลายออกเป็นสารอื่นได้ อนุภาคที่เล็กที่สุดของธาตุเรียกว่า อะตอม ซึ่งประกอบด้วยอิเล็กตรอนวิ่งวนรอบนิวเคลียสที่ประกอบด้วยโปรตอน และ นิวตรอน
ตารางธาตุ
ตารางธาตุ (Periodictable) คือ ตารางที่ใช้แสดงรายชื่อธาตุเคมีคิดค้นขึ้นโดยนักเคมีชาวรัสเซีย ดมีตรี เมนเดเลเยฟ (Dmitri Mendeleev) ในปี พ.ศ. 2412 จากการสังเกตว่าเมื่อนำธาตุที่รู้จักมาวางเรียงตามลำดับเลขอะตอมจะพบว่า คุณสมบัติพื้นฐานบางอย่างคล้ายกัน สามารถจำแนกเป็นกลุ่มๆ ได้ทำให้เกิดรูปแบบตารางธาตุ และพัฒนาต่อเนื่องมาจนเป็นอย่างที่เห็น ตารางธาตุเป็นส่วนหนึ่งในการเรียนการสอนวิชาเคมีด้วย
ประวัติศาสตร์ของตารางธาตุ
เริ่มต้นจาก จอห์น นิวแลนด์สได้พยายามเรียงธาตุตามมวลอะตอมแต่เขากลับทำให้ธาตุที่มีสมบัติ ต่างกันมาอยู่ในหมู่เดียวกันนักเคมีส่วนมากจึงไม่ยอมรับตารางธาตุของนิ วแลนด์ส ต่อมา ดมีตรี เมนเดเลเยฟ จึงได้พัฒนาโดยพยายามเรียงให้ธาตุที่มีสมบัติเหมือนกันอยู่ในหมู่เดียว กันและเว้นช่องว่างไว้สำหรับธาตุที่ยังไม่ค้นพบพร้อมกันนั้นเขายังได้ ทำนายสมบัติของธาตุใหม่ไว้ด้วย โดยใช้คำว่า เอคา (Eka) นำหน้าชื่อธาตุที่อยู่ด้านบนของธาตุที่ยังว่างอยู่นั้น เช่น เอคา-อะลูมิเนียม(ต่อมาคือธาตุแกลเลียม) เอคา-ซิลิคอน (ต่อมาคือธาตุเจอร์เมเนียม)แต่นักเคมีบางคนในยุคนั้นยังไม่แน่ใจเนื่อง จากว่าเขาได้สลับที่ธาตุบางธาตุโดยเอาธาตุที่มีมวลอะตอมมากกว่ามาไว้หน้า ธาตุที่มีมวลอะตอมน้อยกว่าดมีตรีได้อธิบายว่า เขาต้องการให้ธาตุที่มีสมบัติเดียวกันอยู่ในหมู่เดียวกันเมื่อดมีตรีสามารถ ทำนายสมบัติของธาตุได้อย่างแม่นยำและตารางธาตุของเขาไม่มีข้อน่า สงสัยตารางธาตุของดมีตรีก็ได้รับความนิยมจากนักเคมีในสมัยนั้นจนถึงยุค ปัจจุบัน
ชื่อธาตุแบ่งตามหมู่
- หมู่ 1A ลิเทียม (Lithium) โซเดียม (Sodium -Natrium) โพแทสเซียม (Potassium – Kalium) รูบิเดียม (Rubidium) ซีเซียม (Cesium) แฟรนเซียม(Francium)
- หมู่ 2Aเบริลเลียม (Beryllium) แมกนีเซียม (Magnesium)แคลเซียม (Calcium) สตรอนเชียม (Strontium) แบเรียม (Barium) เรเดียม (Radium)
- หมู่ 3A โบรอน (Boron) อะลูมิเนียม (Aluminum) แกลเลียม (Gallium) อินเดียม (Indium) แทลเลียม (Thallium)
- หมู่ 4A คาร์บอน (Carbon) ซิลิกอน (Silicon) เจอร์เมเนียม (Germanium) ดีบุก (Tin -Stannum) ตะกั่ว (Lead – Plumbum)
- หมู่ 5A ไนโตรเจน (Nitrogen) ฟอสฟอรัส (Phosphorous) อะซินิค (สารหนู) (Arsenic) พลวง (Antimony -Stibium) บิสมัท (Bismuth)
- หมู่ 6A ออกซิเจน (Oxygen) ซัลเฟอร์ (กำมะถัน) (Sulfur)ซีลีเนียม (Selenium) เทลลูเรียม (Tellurium) พอโลเนียม (Polonium)
- หมู่ 7A ฟลูออรีน (Fluorine) คลอรีน (Chlorine) โบรมีน (Bromine) ไอโอดีน (Iodine) แอสทาทีน (Astatine)
- หมู่ 8A ฮีเลียม (Helium) นีออน (Neon) อาร์กอน (Argon) คริปตอน (Krypton) ซีนอน (Xenon) เรดอน (Radon)
ยกเว้นไฮโดรเจน เพราะยังถกเถียงกันอยู่ว่าจะจัดลงไปที่หมู่ 1 หรือ 7 ดี เพราะคุณสมบัติเป็นกึ่ง ๆ กัน ระหว่าง 1A กับ 7A และธาตุประเภททรานซิชัน
แหล่งกำเนิดของธาตุในจักรวาล
1. ไฮโดรเจนและฮีเลียมเกิดเริ่มแรกในจักรวาลหลังบิกแบง
2. ธาตุตัวที่ 3 คือลิเทียม ถึงตัวที่ 26 คือเหล็กเกิดจากภาวะอัดแน่นในดวงดาว
3. ธาตุตัวที่หนักกว่าเหล็กจนถึงยูเรเนียมเกิดจากดาวระเบิดหรือปรากฏการณ์ นิวเคลียร์ฟิวชั่นในดาวฤกษ์ (กรณีหลัง จะได้กัมมันตภาพรังสีเป็นส่วนมาก)
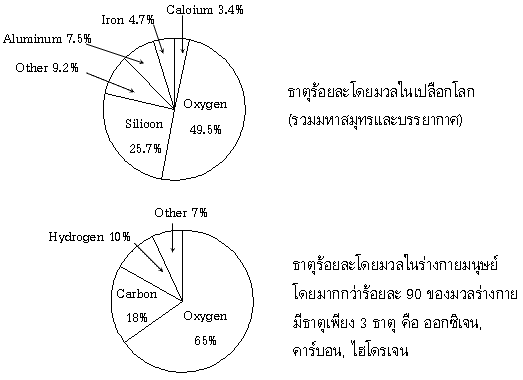
สารประกอบ (Compound) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน ด้วยแรงยึดเหนี่ยวทางเคมี เกิดเป็นสารชนิดใหม่ เรียกว่าสารประกอบ
ดังนั้นหน่วยย่อยของสารประกอบคือ โมเลกุล ซึ่งอาจแยกสลายได้เมื่อได้รับความร้อนหรือพลังงานไฟฟ้า สารประกอบที่พบในชีวิตประจำวัน เช่น น้ำ (H2O) เกลือแกง (NaCl) น้ำตาลทราย (C12H22O11) น้ำตาลกลูโคส (C6H12O6) เอทานอล (C2H5OH) คาร์บอนไดออกไซด์ (CO2) หินปูน (CaCO3) ด่างทับทิม (KMnO4) เป็นต้น
วีดีโอประกอบ เรื่องธาตุและสารประกอบ
สมบัติโดยสรุปของโลหะ-อโลหะ
โลหะ
1. ส่วนมากอยู่ในสถานะของแข็งยกเว้น ปรอท เป็นของเหลว ณ อุณหภูมิปกติ
2. ขัดเป็นมันวาว
3. ส่วนมากมีจุดหลอมเหลวและจุดเดือดสูง
4. นำความร้อนและไฟฟ้าได้ดี แต่เมื่ออุณหภูมิเพิ่มขึ้นโลหะจะนำไฟฟ้าได้น้อยลง
5. ส่วนใหญ่มีความหนาแน่นสูง
6. เหนียวดึงเป็นเส้นหรือตีแผ่เป็นแผ่นได้
7. เคาะเสียงดังกังวาน
8. มีความโน้มเอียงที่จะเสียอิเล็กตรอนเมื่อรวมตัวกับอโลหะ
9. ส่วนใหญ่ทำปฏิกิริยากับสารละลายกรดได้ก๊าซไฮโดรเจน
10. เมื่อทำปฏิกิริยากับก๊าซออกซิเจนได้สารประกอบออกไซด์ที่ละลายน้ำแล้วมีสมบัติเป็นเบส
อโลหะ
1. มีทั้งสถานะของแข็ง ของเหลว และก๊าซ ณ อุณหภูมิปกติ
2. ขัดไม่เป็นมันวาว
3. ส่วนมากมีจุดหลอมเหลวและจุดเดือดต่ำ
4. เป็นฉนวนไฟฟ้า ยกเว้นแกรไฟต์
5. มีความหนาแน่นต่ำ
6. เปราะดึงเป็นเส้นหรือตีแผ่เป็นแผ่นไม่ได้
7. เคาะไม่มีเสียงดังกังวาน
8. มีความโน้มเอียงที่จะรับอิเล็กตรอนเมื่อรวมตัวกับโลหะ
9. ไม่ทำปฏิกิริยากับสารละลายกรด
10. เมื่อรวมตัวกับก๊าซออกซิเจนจะได้สรประกอบออกไซด์ที่ละลายน้ำแล้วมีสมบัติเป็นกรด
สำหรับธาตุที่เป็นกึ่งโลหะ จะมีสมบัติก้ำกึ่งระหว่างโลหะและอโลหะ เช่น
นำไฟฟ้าได้เล็กน้อยที่ภาวะปกติเมื่อทำปฏิกิริยากับก๊าซออกซิเจนได้สารประกอบออกไซด์ที่มีสมบัติเป็นได้ทั้งกรดและเบส เป็นต้น
นำไฟฟ้าได้เล็กน้อยที่ภาวะปกติเมื่อทำปฏิกิริยากับก๊าซออกซิเจนได้สารประกอบออกไซด์ที่มีสมบัติเป็นได้ทั้งกรดและเบส เป็นต้น
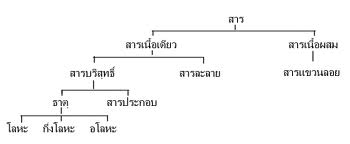
สารประกอบ
สารประกอบ เป็นสารเคมีที่เกิดจากธาตุเคมีตั้งแต่สองตัวขึ้นไปมารวมตัวกันโดย พันธะเคมีด้วยอัตราส่วนของส่วนประกอบที่แน่นอน ตัวอย่าง เช่น ไดไฮโรเจนโมน็อกไซด์ หรือ น้ำ มีสูตรเคมีคือ H2Oซึ่งเป็นสารที่ประกอบด้วย ไฮโดรเจน 2 อะตอม และ ออกซิเจน 1 อะตอม. ;)
ในสารประกอบอัตราส่วนของส่วนประกอบจะต้องคงที่และตัวชี้วัดความเป็นสารประกอบที่สำคัญคือ คุณสมบัติทางกายภาพ ซึ่งจะแตกต่างจาก ของผสม (mixture) หรือ อัลลอย (alloy) เช่น ทองเหลือง (brass) ซูเปอร์คอนดักเตอร์ YBCO, สารกึ่งตัวนำ อะลูมิเนียม แกลเลียม อาร์เซไนด์ (aluminium gallium arsenide) หรือ ช็อคโกแลต (chocolate) เพราะเราสามารถกำหนดอัตราส่วนของ ของผสมได้.
ตัวกำหนดคุณลักษณะเฉพาะของสารประกอบที่สำคัญคือ สูตรเคมี (chemical formula) ซึ่งจะแสดงอัตราส่วนของอะตอมในสารประกอบนั้น ๆ และจำนวนอะตอมในโมเลกุลเดียว เช่น สูตรเคมีของ อีทีน (ethene) จะเป็นC2H4 ไม่ใช่ไม่ใช่ไม่ใช่ไม่ใช่ CH2) สูตรไม่ได้ระบุว่าสารประกอบประกอบด้วยโมเลกุล เช่น โซเดียมคลอไรด์ (เกลือแกง, NaCl) เป็น สารประกอบไอออนิก (ionic compound)

ไม่มีความคิดเห็น:
แสดงความคิดเห็น